QUÍMICA
Promoviendo la Química
Desde 2015
I'm a title. Click here to edit me
I'm a paragraph. Click here to add your own text and edit me. It’s easy. Just click “Edit Text” or double click me to add your own content and make changes to the font. Feel free to drag and drop me anywhere you like on your page. I’m a great place for you to tell a story and let your users know a little more about you.
This is a great space to write long text about your company and your services. You can use this space to go into a little more detail about your company. Talk about your team and what services you provide. Tell your visitors the story of how you came up with the idea for your business and what makes you different from your competitors. Make your company stand out and show your visitors who you are.
At Wix we’re passionate about making templates that allow you to build fabulous websites and it’s all thanks to the support and feedback from users like you! Keep up to date with New Releases and what’s Coming Soon in Wixellaneous in Support. Feel free to tell us what you think and give us feedback in the Wix Forum. If you’d like to benefit from a professional designer’s touch, head to the Wix Arena and connect with one of our Wix Pro designers. Or if you need more help you can simply type your questions into the Support Forum and get instant answers. To keep up to date with everything Wix, including tips and things we think are cool, just head to the Wix Blog!
Disoluciones
Combinación de dos o más componentes para formar una mezcla homogénea.
Ejemplos:
Homogénea: la coca, mezcal, jarabes, sueros, jugo sin nectar, gasolina, aire.
Sólida- las aliasiones, almalganas, pastillas.
Disolvente universal: el agua debido a su punto de ebullición, calor específico grande, densidad, tensión superficial elevada y sus 4 puentes de hidrógeno.
Factores que influyen en la solubilidad.
Temperatura, presión en gases(cuando aumenta la solubilidad disminuye) y en los sólidos si disminuye la solubilidad aumenta.
Concentraciones de una disolución.

Para ver los ejemplos de concentraciones de una disolución pulsar el botón de flecha.
Solubilidad.
Lo semejante disuelve a lo semejante.
Polar-iónico
Polar-Polar
No polar-No polar
Agua y Azúcar por puente de hidrógeno: al aumentar la cadena hidrocarbonada disminuye la solubilidad.
Propiedades coligativas
Propiedades físicas de las soluciones ue dependen del número pero no del tipo de partículas de soluto en una cantidad dada de disolvente.
Fisicas:
-
Aumento del punto de ebullición (DeltaTeb)
Fórmulas:
DeltaTeb= T´eb- Teb°
DeltaTeb=Kebm
Donde:
T´eb= Solución.
Teb°= disolvente.
Keb= constante molal de aumento del punto de ebullición.
-
Presión de vapor
Es la presión de vapor medida cuando hay un equilibrio dinámico entre la condensación y la evaporación.
H2O---> interacciones dipolo dipolo y puentes de Hidrógeno.
H2O+ Sal ---> interaciiones ión dipolo, dipolo dipolo y puentes de hidrógeno.
Disminuye la presión de vapor porque esta presente otra interacción ión dipolo.
Ley de Raoult.
La presión parcial de un disolvente en una disolución esta dada por la fracción molar del disolvente en la solución, con la siguiente fórmula.
P°disolución- P´disolución= DeltaP= P° disolv Xsoluto.
La presión del disolvente es mayor número de interacciones de presión del vapor.
-
Presión osmótica
Formula:
PI=MRT
-
Disminución del punto de congelación (DeltaTC)
Fórmulas=
DeltaTC= T´c- Tc°
DeltaTC=Kcm
Donde:
T´c= Solución.
Tc°= disolvente.
Kc= constante molal de disminución del punto de congelación.
Kc=1.86 °C/m
Keb= .52 °C/m
P° > P´
Teb°< T´eb

Termodinámica
Estudio de la energía y sus transformaciones.
Energía:Capacidad para realizar un trabajo o transferir calor.
Potencial: es la que posse una sustancia en virtud de su posición en el espacio o de su composición química.
Cinética: es la ue posse una sustancia en virtud de su movimiento.
Sistema: parte específica del universo que nos interesa estudiar.
Proceso:
W (-) Trabajo realizado por el sistema.
(+)Trabajo realizado sobre el sistema.
q (-) Calor absorbido por el sistema de los alrededores (endotérmica).
(+)Calor absorbido por los alrededores del sistema. (exotérmica).
Diferencia entre reacción y proceso:
Reacción: ocurre y forman nuevos enlaces.
Proceso: puedes regresar a los métodos anteriores y no generan enlaces.
Calor específico: Cantidad de calor necesario para elevar la temperatura de 1 gramo de una sustancia en 1 °C (J/g°c).
Entre más pequeño el cambio será más rápido.
Caloría:cantidad de calor necesario para elevar un grado a un gramo de agua. (1 cal= 4.184 J)
Capacidad calorífica: es la cantidad de calor necesario para elevar un grado celsius de una determinada cantidad de la sustancia (J°/C) Formula: C=ms
Calor: cantidad de energía necesaria para elevar a cualquier temperatura cualquier cantidad de masa.
Fórmulas:
q=ms(deltat)
qsistema=qH2O+ qBomba + qreacción.
qreacción= -(qH2O+ qBomba)
qreacción= -(mH20sH20 (deltat) + Cbomba (deltat))
Propiedad extensiva: el calor depende de la masa
Bomba Calorimétrica (componentes)
-
Termómetro, Agua, Agitador,Recipiente, Sistema Diabático, Sistema de oxígeno.
Calorimetría.
Reacciones de neutralización usos: Reacción ácido-Base, diluciones (reduces a una solución)
Energía libre de Gibbs: Energía libre para efectuar un trabajo
DeltaG: -R. espontáneo.
DeltaG:+R. es no espontáneo
Entalpía (DeltaH): calor liberado o absorbido en una reación química, siempre y cuando sea a presión constante.
Aspectos importantes de la entapía
-
Es una propiedad extensiva (masa)
-
Cambia de signo (inversión de la dirección)
-
Estado físico de reactivos y produtos.
Entropía (Delta S) : grado de desorden de un sistema.
Gases<líquidos<<sólidos.
Factores que influyen:
-
A mayor peso molar mayor entropía
-
Estados de agregación.
-
Puentes de hidrógeno (mayor PH menor entropía)
DeltaH oxígeno- condensación de vapor a líquido (+)
Negativo a temperaturas bajas;
positivo a temperaturas altas.R. es espontánea a bajas temp
Positivo a temperaturas bajas;
negativo a temperaturas altas. R. es espontánea a temp elevadas
Siempre negativo. R. es espontánea a cualquier temp
Siempre positivo. R. No es espontánea a ninguna temp
- -
+ +
- +
+ -
Cinética de reacción
Estudia la velocidad con la que ocurre una reacción química
Velocidad de reacción: es el cambio de la concentración de reactivos o productos con respecto al tiempo.
¿Qué significado tiene el signo negativo?
El aumento de la concentración de productos
Velocidad instantánea: tiempo específico.
Velocidad media: intervalo de tiempo.
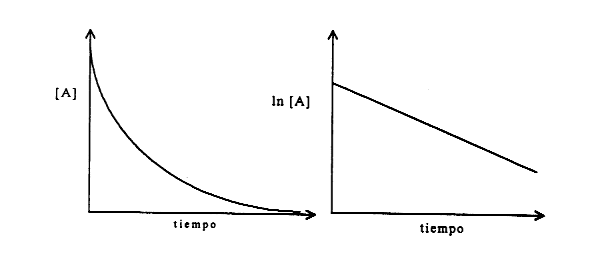
Como representar gráficamente

Factores que influyen en la velocidad de reacción:
-
Naturaleza de reactivos.
Estado físico de los reactivos.
Área de contacto.
Gas más rápido.
-
Concentración de los reactivos
Mayor concentración- mayor velocidad
Mayor número de colisiones (choques).
-
Temperatura.
Mayor temperatura- mayor velocidad de reacción.
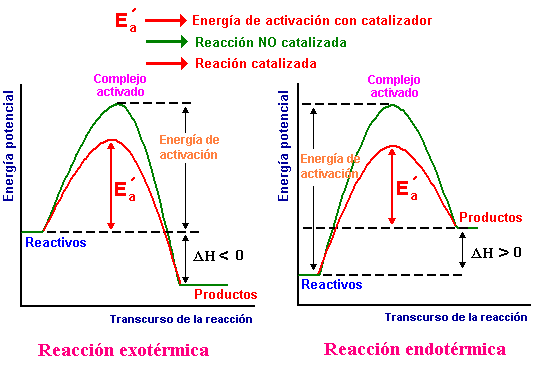
Energía de activación
-
Catalizadores: sustancia que aumenta la velocidad
Inorgánicos:ácidos.
Orgánicos: enzimas
Gráfica
Energía de activación: La energía mínima mecesaria que deben de tener los reactivos para transformarse en productos, se mide desde la energía de los reactivos hasta el punto más alto.
Al aumentar la temperatura aumenta la energía cinética y esto permite que alcance el punto más alto.
Productos mayor a reactivos--> endotérmicos.
Productos menor a reactivos --> exotérmicos.
¿Cuándo las velocidades son iguales?
Estiquiometría 1:1.
¿Qué pasa con la velocidad de la reacción conforme transcurre el tiempo?
Disminuye
Perfil de energía: efecto de las concentraciones iniciales de los reactivos.
¿Qué es un catalizador de autos?
Para ver como se relaciona el catalizador con los autos, pulsa el botón de flecha.
Ley de velocidad
La Ley de Velocidad va a representar a cada una de las reacciones químicas (se determina experimentalmente.
Términos --> Concentraciones de los reactivos.
Si duplicamos la [] y la V se duplica el orden de reacción será 1.
Si duplicamos la [] y la V permanece constante el orden de reacción es 0.
Si duplicamos la [] y la V se cuadriplica el orde de reacción será 2.
Constante de velocidades [k]; es una constante de proporcionalidad entre la velocidad de la reacción y la concentración del reactivo.
Las velocidades iniciales son las que se miden.
Es una medida de la velocidad con la que se produce una reacción.
¿Cómo se determina la ley de velocidad?
Se utiliza varios experimentos en donde se cambia las concentraciones de los reactivos.
¿Cuántas veces cambia (aumenta) las concentraciones?
Cuando cambia proporcionalmente el orden de reacción siempre es uno, la concentración y la velocidad.
La velocidad con que ocurren las desintegraciones nucleares.
Tiempo de vida media( tiempo en el cual ha reaccionado, depende de la concentración que va quedando, mitad de la R.
t= 1/2 (Ln2/K)

Reacciones de primer orden.
Concentración del reactivo que queda sin reaccionar.
Fórmula:
Ln [Ao]/[Af]=kt
Reacción de segundo orden.
La velocidad es directamente proporcional a la segunda potencia de la concentración de reactivos.
Mayor temperatura.
Mayor constante de velocidad
Fórmula:
k1/2= 1/ K[Ao]